
Denne artikkelen er republisert fra Cygnus nr 18, 2011.
Av Brede Andreassen*, Per Oscar Bremer**, Brit Solveig Farstad***, Dag-Erik Heggli**** og Nils Kaltenborn*****
* Kjemiingeniør fra Göteborg Tekniska Institutt, Göteborg 1967. Ingeniør ved Isotoplaboratoriene, Institutt for energiteknikk 1968–1996. Salgs og informasjonsansvarlig ingeniør i Isopharma A.S. 1996–2003. Sales manager Molecular Imaging GE Healthcare 2004–2011. Adresse: Hovinbakken 63. 1900 Fetsund.
** Cand.pharm. Universitetet i Oslo 1967. M. Sci. Pharmaceutical technology Kings College, London 1973. Forsknings assistent ved avd. for galenisk farmasi, Farmasøytisk institutt 1968. Provisor ved produksjons og forskningsavdelinger ved Apothekernes Laboratorium for specialpreparater 1969–1975. Leder for radiofarmasøytisk avdeling ved IFE 1976–1989. Sjef for Isotoplaboratoriene ved IFE og forskningsdirektør for radiofarmasøytisk forskning 1989–1996. Administrerende direktør for Isopharma AS 1996–2003. Sjef for formulering av radiofarmaka og senior spesialist i GE Healthcare 2003–2009. Adresse: Platåveien 12. 1369 Stabekk.
*** Cand.pharm. Universitetet i Oslo 1986. Forskningsleder og kontrollsjef ved Isotoplaboratoriene ved Institutt for Energiteknikk (IFE) 1986–1996. Seksjonsleder for kontroll og distribusjon ved Isotoplaboratoriene 1997–2000. Avdelingssjef for Isotoplaboratoriene 2000–2010. Forskningsdirektør for sektor Nukleærteknologi og fysikk ved IFE fra 2010. Adresse: Hovinbakken 63. 1900 Fetsund.
**** Cand.pharm. Universitetet i Oslo 1979.Forskningsleder ved Isotoplaboratoriene ved IFE 1980–1986. Forskningssjef Axis Shield 1986-1996. QA sjef i Isopharma 1996-2003. Produksjonsleder for radiofarmaka og ansvarshavende for PET radiofarmaka i GE Healthcare AS fra 2003 til dags dato. Adresse: Sagdalsveien 25A, 2010 Strømmen.
***** Siv.ing. Kjemi fra NTH Trondheim 1958. Leder av seksjonen for bestrålingsteknologi og stedfortredende isotopsjef ved Isotoplaboratoriene, IFE 1958–1996. Viseadministrerende direktør i Isopharma AS 1996–2002. Adresse: Kjerulfs gate 35, 2000 Lillestrøm.
Det har vært skrevet en del om radiofarmasi i Norge, oftest med fokus på de første årene i historien til dette relativt nye fagfeltet. Denne presentasjonen beskriver hva som hendte etter den første pionertiden. Både hva som hendte på lokalt plan i Norge og hvorledes det norske radiofarmasi miljøet fikk være med på å prege utviklingen på fagområdet i resten av Europa og utenfor. I de siste ti årene har det skjedd store forandringer i fagmiljøet her i Norge. Situasjonen i dag og fremtidsutsiktene for feltet omtales avslutningsvis.
I de aller fleste land er radiofarmasi oppstått som et «biprodukt» av kjernefysisk forskning. Så også i Norge, og her skjedde dette spesielt tidlig. Allerede i 1952 ble de første preparatene til medisinsk bruk levert fra Institutt for Atomenergi på Kjeller, og det var bare seks år etter den første leveransen i verden skjedde fra forskningsinstituttet ved Oak Ridge i Tennessee, USA.
Etter et fantastisk forarbeid, både politisk, økonomisk og teknisk, av pionerene Gunnar Randers og Odd Dahl, kunne kjernereaktoren JEEP settes i drift av kong Haakon VII i november 1951 ute på et jorde ved Kjeller i Akershus. Dette var et prosjekt som skulle vise seg å få en enorm betydning for norsk forskning, og som blant annet la grunnlaget for den radiofarmasøytiske virksomheten som vi nå har hatt i Norge i henimot 60 år.
Hvordan var så dette mulig å få til i et lite land som Norge på et så tidlig tidspunkt? Norge startet et samarbeidsprosjekt med Nederland for å bygge en atomreaktor. Norge hadde tungtvann fra Norsk Hydros anlegg på Rjukan og Nederland hadde uran, som de hadde klart å skjule for tyskerne under okkupasjonen. Da reaktoren ved Institutt for Atomenergi (IFA), som det het den gangen ble satt i drift, åpnet dette for muligheten til produksjon av isotoper både til teknisk og medisinsk bruk. De første leveransene av radioaktive preparater til medisinsk bruk var radioaktivt jod i form av natriumjodid [131I] natriumjodid (1).
Etter at de første dosene med radioaktivt jod ble levert til Ullevål sykehus i slutten av 1952, ble produksjonen økt kraftig i de neste årene. Det ble fremstilt stadig flere forskjellige radioaktive isotoper, beregnet både til medisinsk og teknisk bruk. Totalt ca. 300 leveranser i 1953, økende til 2200 leveranser i 1959. Det er sannsynlig at antallet pasientdoser økte enda mer siden aktivitetsmengden per leveranse også økte i denne perioden. Omkring 75 % av isotopleveransene gikk til medisinsk bruk. Av dette var nesten 50 % [131I] jod, fulgt av [32P] fosfor, [24Na] natrium, og [198Au] gull.
De øvrige skandinaviske land viste tidlig stor interesse for isotopproduksjonen på Kjeller, og eksporten til nabolandene ble betydelig i årene som fulgte. Det ble også i disse årene levert radioaktive preparater fra Kjeller til andre land i Europa, men dette var i en noe mindre skala.
I 1957 ble den første medarbeideren med farmasøytisk bakgrunn, Oddvar Kjensli, ansatt som produksjonsleder ved isotoplaboratoriene på IFA. Det skulle etter hvert komme flere farmasøyter, og Kjeller ble det første produksjonssenter i Europa der disse radioaktive produktene ble definert som legemidler, eller «radiofarmaka». Ved de største sykehusene ble det etablert «isotoplaboratorier», som senere ble til nukleærmedisinske avdelinger, etter at nukleærmedisin ble en godkjent medisinsk spesialitet. (Mer om dette i avsnittet «Lovgivning og regelverk».)
Fra 1963 kunne IFA tilby 28 forskjellige radioaktive isotoper fordelt på mer enn 50 forskjellige preparater. Kjeller ble etter hvert anerkjent for sin ekspertise innen såkalt merkingsteknologi hvor radioaktive isotoper av for eksempel elementet jod kunne inkorporeres i ulike kjemiske substanser. I produktkataloger fra midten av 1960-tallet kan man finne hele 21 forskjellige radiofarmaka merket med den radioaktive isotopen [131I] jod og 8 preparater basert på isotopen [125I] jod (2).
Behov for nye typer isotoper i medisinen
På slutten av 60-tallet økte behovet for radiofarmaka som innehold isotoper med gammastråling og hadde kort halveringstid. Det er bare gammastråling som kan benyttes til bildediagnostikk. Kort halveringstid kombinert med ren gammastråling gir pasienten de laveste stråledosene. Derfor ble etter hvert de fleste radiofarmaka med isotopen [131I] jod, med halveringstid 8 døgn og med både beta- og gammastråling, erstattet med isotopen [99mTc] technetium som har en halveringstid på bare 6 timer og sender ut ren gammastråling. [99mTc] technetium skulle bli den mest anvendte radionuklide i verden til nukleærmedisinsk bildediagnostikk.
Technetium [Tc] som element med atomnummer 43, var et åpent hull i grunnstoffenes periodiske system før det ble fremstilt ved hjelp av kjernereaksjoner i 1937. Det fikk derfor navn fra det greske «technetos» som betyr kunstig. Alle isotoper av technetium er radioaktive og elementet finnes i naturen bare i svært små mengder som fisjonsprodukter fra uranmalm.
I 1957 klarte to forskere ved Brookhaven National Laboratory i USA å fremstille [99mTc] technetium ved hjelp av det som senere skulle kalles en radionuklidegenerator. Prinsippet går ut på at den radioaktive isotopen [99Mo] molybden henfaller ved å avgi en betapartikkel og dermed omdannes til en ny radionuklide, [99mTc] technetium. Siden [99Mo] molybden og [99mTc] technetium er isotoper av ulike elementer har de ulike kjemiske egenskaper og kan derfor separeres fra hverandre kjemisk (3).
En slik molybden/technetium-generator ble patentsøkt i USA i 1958, men søknaden ble avslått med begrunnelse i at metoden ikke kunne sees å ville få kommersiell interesse.Ti år senere ble det årlig omsatt slike generatorer i USA for 200 millioner USD.
Molybden/technetium-generatoren
I Norge ble den første technetium/generatoren konstruert ved IFA, Kjeller i 1966. En viktig praktisk fordel er forskjellen i halveringstid mellom de to nuklidene som inngår, [99Mo] molybden (ca. 3 døgn) og [99mTc] technetium (6 timer). Halveringstiden for den første nukliden gjør det mulig med transport over betydelige strekninger, hvor omgivelsene er sikret mot stråling fra nukliden som er plassert bak en tykk blyskjerm. (Systemet ble ofte populært kalt en «isotop ku»). Vel fremme på sykehuset kan man «melke» generatoren hver dag i en uke og eluere ut steril radioaktiv løsning, som inneholder isotopen [99mTc] technetium, som har en halveringstid og strålingsegenskaper som sikrer pasienten en lav strålingsdose.
Produktet man derved har skaffet seg, [99mTc] natriumpertechnetat [NaTcO4] i vandig løsning, har imidlertid begrenset anvendelse innen nukleærmedisin. Det var først etter at elementets kjemiske egenskaper ble bedre kjent og det ble mulig å utvikle ulike preparater merket med [99mTc] technetium at interessen for denne radionukliden ble stor. På 1970- og 80-tallet ble det utviklet en rekke ulike preparater i form av frysetørrete substanser til merking med [99mTc] technetium. Dette var såkalte preparasjonssett eller «kits» som kunne tilsettes technetium-99m eluat, og derved fikk man tilberedt radiofarmaka med ulike indikasjonsområder. De kunne for eksempel anvendes til måling av blodgjennomstrømning i hjertemuskulaturen, påvisning av metastaser i skjelettet eller påvisning av blodpropper i lungene (4).
I årene som fulgte ble det designet flere nye generatormodeller på Kjeller. Etter hvert som behovet for mer [99mTc] technetium aktivitet ble større, måtte mengden med molybden i generatoren økes.Tykkelsen av blyskjermingen måtte økes tilsvarende for å beskytte sykehuspersonalet mot den radioaktive strålingen ved håndteringen av generatoren.
Både design av ulike [99mTc] technetium generator modeller og selve produksjonsteknologien ble utviklet og konstruert lokalt ved Isotoplaboratoriene på Kjeller. Primært skulle IFE (Institutt for energiteknikk ble det nye navnet etter skifte i 1980) dekke det norske behovet for radiofarmaka, herunder også [99mTc] technetium generatorer. Likevel ble det etter hvert en omfattende eksport til de øvrige skandinaviske land, og i Danmark var den norske generatoren i mange år markedsledende.
Fra begynnelsen av 1960-tallet viste både FN-organisasjonen IAEA (International Atomic Energy Agency) og innen- og utenlandske kommersielle firmaer, interesse for produksjonsteknologien som var utviklet på Kjeller. Flere av Isotoplaboratorienes medarbeidere hadde oppdrag for IAEA både sentralt ved hovedkontoret i Wien og som utsendte eksperter til blant annet Egypt, Filippinene og Syd-Korea. Som en direkte følge av samarbeidet med IAEA er produksjon av technetiumgeneratorer basert på norsk utviklet teknologi vel etablert i Tyrkia og Malaysia.

Gjennom hele 1980- og 90-tallet ble norsk radiofarmasøytisk produksjonsteknologi og produktdesign eksportert til flere land. Spania var det første landet som mottok full «produksjonspakke» for [99mTc] technetium generatorer. Dette inkluderte montering av produksjonsutstyr ved et nukleærfarmasøytisk senter utenfor Madrid, samt opplæring av lokalt personell i GMP («Good Manufacturing Practice»). Det private nukleærfarmasøytiske sentret ved Madrid ble på kort tid den største produsenten av technetium-99m preparater i Spania.
Teknologiutviklingen fortsatte med kontinuerlig fokus på produktforbedring også etter 1996, da Isopharma AS og senere General Electric Healthcare AS overtok ansvaret for produksjon av radiofarmaka i de samme laboratoriene på IFE, Kjeller. Produksjonen av [99mTc] technetium generatorer i Norge ble avsluttet i 2008 da GE Healthcare AS valgte å stanse den generelle produksjonen av radiofarmaka i Norge.
Isotoplaboratoriene ved IFE hadde en utstrakt kontakt mot internasjonale fagmiljøer og forsknings sentere. Mye av utviklingen innen radiofarmasien var på 80-tallet basert i universitetsmiljøer og samarbeidet var i svært liten grad sperret av patenter eller av store kommersielle radiofarmakaprodusenter. Dette åpnet for at Kjeller-miljøet kunne få tilgang til substanser og prosedyrer for å syntetisere og formulere nye radiofarmaka uten bindinger av patenter eller andre begrensninger. Flere produkter ble utviklet ved Isotoplaboratoriene som en integrert aktivitet av den generelle radiofarmasøytiske virksomheten ved avdelingen. Rutine produksjonen av radiofarmaka gikk hånd i hånd med formulering av nye produkter. Dette gjorde at veien ble kort fra utprøving av nye molekyler og merkingsmetoder frem til ferdigstilling av et radioaktivt legemiddel til testing eller klinisk bruk. Norge fikk dermed tidlig tilgang på nye, unike legemidler, slik at norske sykehus ofte var i fronten av utviklingen på det nukleærmedisinske området.
Eksempler på viktige legemidler som ble utviklet av gruppen på Kjeller, er [131I] jod merket kolesterol, [131I] jod merket norkolesterol, [131I] jod merket methyl benzylguanidin (MIBG) og en rekke frysetørrete «kits» (Radiofarmaka halvfabrikata) for merking med [99m Tc] technetium.
De to radioaktivt merkede kolesterolsubstansene ble begge brukt til studier av svulster i binyremargen (5). IFE fikk tilgang til den første kolesterolsubstansen og en del av grunnforskningen fra universitetsmiljøer i USA. Siden syntesebeskrivelser var åpent tilgjengelig og det ikke fantes formelle hindringer, kunne IFE starte sitt utviklingsarbeide for å skape et kommersielt produkt. Syntesen av råvaren ble ivaretatt av kjemikaliefirmaer i Europa, mens IFE selv utviklet merkingsteknologi, farmasøytiske fremstillingsforskrifter og kontroll metoder. Med det gode samarbeidet med norske nukleærmedisinske avdelinger kom produktet hurtig i klinisk utprøvning. Etter et par år på markedet ble produktet vesentlig forbedret, da det viste seg at en forurensning i preparatet, kolesterol analogen 6-jodmetyl-19-norkolesterol, hadde et meget høyere opptak i målområdet.Ved å fremstille denne varianten som en ren substans og merke den med [131I] jod ble produktet jod-131-norkolesterol skapt. Dette produktet ble i en årrekke produsert i Norge og solgt på hele det europeiske markedet og andre deler av verden gjennom samarbeidspartnere i Nederland og Frankrike.
Jod-131 MIBG er [131I] jod merket metaiodo-benzyl-guanidin, som er en noradrenalin analog. Det radioaktive legemiddelet tas aktivt opp i adrenergt nervevev og brukes til påvisning av tumorer i binyrebarken. Utviklingen av dette legemiddelet har en tilsvarende historie som kolesterol preparatene. Felles for disse produktene er at de første kommersielle produktene i verden ble utviklet og formulert på Kjeller.

Technetium kit utvikling
Techentium-generatoren ble etter hvert den viktigste arbeidshesten i nukleærmedisinen. Den sterke økningen i forbruket av denne isotopen, førte til at det ble utviklet en rekke nye og enklere «kits» for merking med [99mTc] technetium. IFE var også her tidlig ute med å utvikle produkter som var lette og enkle å bruke for kundene. De første preparatene var basert på «våt-kjemi» og det ble utviklet til dels meget kompliserte formuleringer. Dette var mulig så lenge produksjonen foregikk i en liten skala med mye manuell håndverksfremstilling. Mange av de løsningene som ble valgt var nok ikke i tråd med hva vi i dag forventer av GMP fremstilling. Det samme gjaldt kravene som ble stilt til dokumentasjon av både råvarer og kvalitetskontroll. Men det viktigste elementet i arbeidet med å forbedre produktene var å forenkle tilberedning av det ferdige radioaktive legemiddelet på sykehusavdelingen umiddelbart før bruk. I Norge var det for eksempel bare et fåtall sykehus som hadde farmasøytisk personell som overvåket eller ga råd om slik tilberedning, og det ble derfor arbeidet meget med å gjøre produktene så enkle og brukssikre som mulig. Etter hvert ble det utviklet kjemiske prosesser som gjorde det mulig å samle alle de ulike komponentene i en løsning som kunne frysetørres hurtig for å bevare reaksjonsegenskapene.
IFE var tidlig ute med å tilpasse produksjonsprosessene slik at dette kunne la seg gjøre. Mye av kjemien baserer seg på at pertechnetat skal reduseres ved hjelp av et tinnsalt slik at technetiumionet er i en kjemisk tilstand som tillater en binding eller kompleksdannelse med det målsøkende molekylet. Det er derfor viktig at fremstillingsprosessen for legemidlet er slik at kun en liten mengde med tinnsalt tilsettes produktet. Tinnets reduksjonsevne må bevares under fremstillingen og det må ikke reagere med andre kjemikalier under fremstillingen. Dette setter store krav til renheten på kjemikaliene som inngår i produktet, og tiden og miljøet som anvendes under produksjonen. Mye arbeid ble derfor lagt ned for å finne riktige renhetsgrad for kjemikaliene for å hindre oksidering av reduksjonsmiddelet. Beskyttende nitrogenatmosfære ble benyttet for å beskytte produktet under produksjonen og erstattet luft i flaskene etter frysetørring.
Ved utviklingen av denne produktgruppen var IFE i front forskningsmessig og var meget tidlig ute med en rekke nye technetium-kit. Isotoplaboratoriene laget over 10 forskjellige «kits» til ulike indikasjoner. Her skal det bare nevnes to av disse produktene. Technetium99m mebrofenin utviklet på IFE var et av de første preparatene på det europeiske markedet for undersøkelser av lidelser i galleveiene (6). Technetium-99m MDP (metylendifosfonat) er svært viktig preparat for tidlig påvisning av kreftspredning til skjellettet. Det har spesielt vært brukt meget til oppfølging av pasienter med bryst eller prostatakreft. Det viste seg at selv om produktene fra forskjellige produsenter inneholdt det samme målsøkende molekylet hadde sammensetningen av preparatene og fremstillingsprosessen stor betydning for kvaliteten av undersøkelsene. MDP-produktet fra Kjeller hadde et meget godt omdømme og kom meget godt ut i en europeisk sammenlignende undersøkelse av preparatene (7).
I hele Europa var produksjon, omsetning og kontroll av radioaktive stoffer til medisinsk bruk preget av at disse produktene ikke var klassifisert som legemidler og derfor ikke var omfattet av de nasjonale godkjennings- og kontrolloppleggene. Det eneste land hvor produktene helt fra starten ble behandlet som legemidler var i Norge.
Produktene var i Norge fritatt for vanlig registreringsplikt (myndighetsgodkjennelse) men all omsetning skulle skje gjennom Isotoplaboratoriene ved Institutt for Atomenergi (IFA) på Kjeller (8).
I andre land ble stoffene betraktet som radioaktive kjemikalier, og de ble som regel fremstilt ved de nasjonale kjerneforskningsinstituttene, ofte nærmest som en ren serviceproduksjon for sykehusene. Prisen på produktene reflekterte på ingen måte de investeringer som ville vært nødvendige om virksomheten skulle underlegges kommersielle betingelser. Dette hadde en historisk bakgrunn fra de første leveransene til sykehusene i USA, som var svært billige, og dette prin- sippet ble stort sett videreført i Europa.
Forskningsreaktorer
Det var sett på som svært prestisjefullt å ha atomreaktorer med tilhørende forskningsenheter i de første tiårene. Produksjon av radioaktive stoffer til medisinsk bruk ble i mange tilfelle brukt som en brekkstang for å få bevilget offentlige midler til bygging av slike sentere. I de fleste land i Europa hadde man slike atomforskningsanlegg med produksjon av isotoper til medisinsk bruk til langt ut på 1980-tallet. Lokal produksjon av radioaktive legemidler ble brukt som argument for opprettelse av atomforskningsinstitutt i mange land i Afrika og Asia helt frem til slutten av det forrige århundret.
I Europa så man etter hvert forsøk på samarbeid om produksjon og distribusjon av produktene. Belgia, Frankrike og Italia dannet en sterk allianse, som fikk betydelig konkurranse fra private kommersielle aktører i markedet, Mallinckrodt i Nederland, Hoechst i Tyskland og ikke minst Amersham International i Storbritannia. Dette siste selskapet hadde sitt utspring i det statlige «The Radiochemical Centre» og dette var det første engelske statsselskapet som ble privatisert, da Margaret Thatcher var statsminister.
I Norden hadde alle de fire landene sin egen produksjon ved de nasjonale atomanleggene: Risø i Danmark, Studsvik i Sverige, Kjeller i Norge og ved den tekniske høyskolen utenfor Helsinki i Finland. Produksjonen på Kjeller var den eldste og den mest omfattende, og det var allerede tidlig en relativt stor eksport fra Norge til de andre nordiske landene. Det som også gjorde den norske virksomheten spesiell var at den var så preget av farmasøytisk tankegang. Etter at provisor Oddvar Kjensli ble ansatt som ansvarshavende for produksjonen i 1957 økte antallet farmasøyter stadig, slik at det i 1995 var hele 12 provisorer og reseptarer i virksomheten på Kjeller, som den gang hadde et personale på 46 personer. Farmasøytene var involvert i alle deler av virksomheten fra produksjon og kontroll til forskning og utvikling.
Nordisk samarbeid
Som på de fleste felt, prøvde man også her å få i stand et nordisk samarbeid. Fra midten av 60 tallet ble det startet med nordiske møter for å se om det kunne legges opp til en felles strategi og en plan for delt produksjon av de ulike radioaktive legemidlene mellom aktørene. Disse regelmessige møtene kom til å få stor betydning på mange områder i årene som kom. Møtene var åpne og uformelle, og det som var meget positivt var at legemiddelmyndighetene i alle fire land deltok. Det var unikt i europeisk sammenheng med møtekontakt mellom produsenter og kontrollmyndigheter i en helt uforpliktende form. En rekke av de spørsmål og retningslinjer som ble drøftet på nordisk plan fikk senere stor betydning for utforming av lovgivning og regelverk for radioaktive legemidler i hele Europa.
Samarbeidet om produksjonsfordeling av radioaktive legemidler i de nordiske landene ble ingen særlig suksess. Enkelte av produktene var mer attraktive å produsere enn andre med hensyn til salgsvolum og total økonomi, og referatene fra disse møtene gjenspeiler en varig uenighet om hvilke produkter som skulle produseres hvor. IFE hadde et vesentlig større produktspekter enn de tre andre produsentene. Norge fikk en stor eksport spesielt til Danmark, hvor IFE i mange år dominerte salget av technetiumgeneratorer og tilhørende preparasjonssett. Også til Sverige og Finland var det en ikke ubetydelig eksport.
Felles nordisk regelverk
Når det gjaldt samarbeid om regler og retningslinjer for radiofarmaka var suksessen betydelig større. Det hele ble mer formalisert da Sundhedsstyrelsen i Danmark opprettet et eget Isotopapotek som var offisielt i drift fra 1974. Det skulle ha ansvar for godkjennelse av radioaktive legemidler i Danmark, hvor det nå ble innført registreringsplikt for denne legemiddelgruppen. I tillegg skulle apoteket ha tilsyn med omsetning og distribusjon av legemidlene og utvikle metoder for kvalitetskontroll. Sammen med de nasjonale strålevernsmyndighetene skulle de ha tilsyn med fremstilling og tilberedning av radiofarmaka lokalt på sykehusene, en virksomhet som var ganske utbredt på den tiden (9).
Opprettelsen av det danske isotopapoteket fikk også følger for Isotoplaboratoriene på Kjeller og kom til å forandre arbeidet i de nordiske møtene. Nå ble det kontroll og kvalitetsstandarder som ble satt i høysetet. Begrepet «Good Manufacturing Practice» var velkjent i vanlig farmasøytisk industri, men det var faktisk arbeidet i den nordiske gruppen som førte til den første publikasjonen om anvendelse av disse prinsippene på radioaktive preparater til medisinsk bruk. Artikkelen ble publisert så tidlig som i 1971 (10). Den fokuserte sterkt på at radiofarmaka var svært forskjellige fra vanlige legemidler og at det derfor måtte etableres et eget regelverk som tok hensyn til dette. Sentralt i denne argumentasjonen var at produktene hadde kort brukstid og små produksjonsvolum. I tillegg omfattet det leveranse av halvfabrikat direkte til sykehus uten at produktene var innom et apoteksledd på veien fra produsent til bruker. De samme argumentene og en rekke andre i tillegg, kom til å prege debatten om regelverket for radiofarmaka i Europa i mange år fremover.
Farmakopé-samarbeid
Det ble oppnådd et godt samarbeid over landegrensene i Norden for å utvikle bedre kontrollmetoder og øke kvaliteten på produktene. Prøver ble sendt fra produsenten i et land til kontrollaboratorier i de tre andre for å utvikle standarder og kontrollmetoder. Dette var noe som ikke hadde skjedd tidligere på radiofarmakaområdet. Norge og Danmark videreførte dette arbeidet ved å ha representanter i Gruppe 14 for Radiofarmaka i Den Europeiske Farmakopé, og etter hvert deltok også Sverige i denne gruppen. En rekke monografier for radiofarmaka ble utviklet ved laboratoriene på Kjeller og det norske miljøet fikk mulighet til å være med på utformingen av det store generelle kapitlet om radiofarmaka i farmakopéen (11).
Danmark ble medlem i EU allerede i 1973 og fikk en meget viktig posisjon på området radioaktive legemidler i fellesskapet gjennom Isotopapoteket, som stadig ble styrket og fikk øket sin innflytelse. Gjennom de nordiske radiofarmasimøtene var det nå mulig for de andre nordiske landene å få innflytelse på utformingen av lovgivningen i Europa også før Sverige og Finland ble medlemmer i EU i 1995.
Nordiska Läkemedelsnämnden – viktige publikasjoner
Ved siden av de nordiske møtene var det også et annet nordisk initiativ som fikk stor betydning for lovgivning og regelverk i Europa. Nordiska Läkemedelsnämnden ble startet av Nordisk råd i 1975 med mål å harmonisere lovgivning og retningslinjer for legemidler i Norden. NLN-samarbeidet førte til tre publikasjoner på radiofarmasiområdet som fikk betydning for lovgivningen i resten av Europa. Gjennom internasjonalt samarbeid la det også grunnlaget for retningslinjer for lovgivning og regelverk i Sentral- og Syd- Amerika samt noen land i Asia.
Den første publikasjonen fra NLN: «Radiopharmaceuticals. Drug Applications» hadde til hensikt å identifisere hvilken dokumentasjon som var nødvendig for å evaluere sikkerhet og effekt for radiofarmaka og kombinere dette med de krav som var gjeldende for konvensjonelle legemidler og de krav som stilles til strålevern ved bruk av slike preparater (12).
Den andre publikasjonen: «Radiopharmacy. Preparation and Control of Radiopharmaceuticals in Hospitals» etablerte retningslinjer for tilberedning, kontroll og håndtering av radioaktive legemidler på sykehus. Bare en liten del av radioaktive legemidler leveres til sykehusene i bruksferdig form, og denne legemiddelgruppen er derfor karakterisert ved at den siste del av fremstillingen av legemiddelet skjer umiddelbart før bruk. Prinsippene for Good Radiopharmacy Practice fikk en meget sentral plass i disse retningslinjene. Dette var viktig fordi den avsluttende fremstillingen av preparatene på sykehuset ikke ble foretatt eller overvåket av farmasøyter (13).
Den tredje publikasjonen «Short-lived Radionuclides for Positron Emission Tomography. Application of the EC Guidelines for Radiopharmaceuticals» omhandlet den nye, viktige radiofarmakagruppen til PET-undersøkelser, som omfatter radionuklider med meget kort halveringstid. Det viktigste produktet inneholder en fluorisotop, [18F] fluor, som har en halveringstid på 2 timer, mens andre PET produkter kan inneholde isotoper med halveringstid på bare noen få minutter. Dette stiller en rekke nye krav til produksjon, kontroll og distribusjon for denne legemiddelgruppen (14).
EU og radiofarmaka
EU fikk utarbeidet sitt første direktiv om radiofarmaka i 1989, dette trådte i kraft i 1993 (14). I prinsippet omfattet dette direktivet også PET-radiofarmaka, men i praksis viste det seg at noe fleksibilitet var nødvendig. NLN-publikasjonen om PET radiofarmaka som ble publisert i 1998 bygger på det generelle direktivet om radiofarmaka og tar i tillegg med viktige punkter som er helt spesielle for PET-radiofarmaka.
Det første EU-direktivet førte med seg positive ringvirkninger. Det ble endelig fortgang i kontroll- og registreringsrutiner i alle medlemsstatene. For nye radiofarmaka var det blitt innført myndighets godkjenning. Men alle de eldre produktene, som i stor grad dominerte bruken i markedet, var ikke omfattet av kontrollordningen. Her klarte man imidlertid å bli enige om å lage en kjempedugnad i hele Europa for å rette på dette. Det skulle utformes felles SPC (Summary of Product Characteristics) for disse produktene, og arbeidet med å utarbeide disse ble fordelt mellom produsentene.
Deretter ble alle produktene fordelt på de ulike legemiddelmyndighetene i deltakerlandene, slik at to land sammen bedømte hvert produkt. Produsentene fikk en kjempeoppgave, for alt arbeid med SPC og produktspesifikke opplysninger skulle utarbeides og sendes inn i løpet av 12 måneder. Gruppen på Kjeller hadde til oppgave å samle dokumentasjon for over 20 av sine produkter, og klarte å levere innen tidsfristen i 1992 (16).
Selv om denne godkjenningsdugnaden ikke ble en 100 prosent suksess, bidro den i sterk grad til at radioaktive legemidler nå ble en naturlig integrert del av legemiddellovgivningen i hele Europa. En del av kontrollmyndighetene klarte riktignok ikke å holde tidsfristene som var satt, og dette skyldtes delvis at de ikke hadde tilstrekkelig kompetanse på radiofarmakaområdet.
For å skape et godt samarbeid i et lite fagmiljø valgte Norsk Selskap for Nukleærmedisin at også andre yrkesgrupper enn medisinere fikk være medlemmer i selskapet, og dette førte til et meget godt samhold mellom leger, farmasøyter, bioingeniører, fysikere og sykepleiere. En av de mest positive opplevelsene for radiofarmasimiljøet på Kjeller har nettopp vært den unike kontakten som ble knyttet med de 20 nukleærmedisinske avdelingene i Norge. Gjennom innsatsen i miljøet var de også med på å støtte nukleærmedisinen og arbeidet med å gjøre det til en medisinsk spesialitet. Farmasøytene var i sterk grad med på å prege miljøet. Helt fra starten ble det alltid valgt inn en representant fra Kjeller i selskapets styre, og den første ikke-medisiner som ble valgt til formann i selskapet var en farmasøyt fra Isotoplaboratoriene, Ole Kristian Hjelstuen.
Farmasøyter og ingeniører fra Kjeller har hele tiden vært meget engasjert med undervisning og etterutdannelse ved de årlige seminarene i selskapets regi. De underviser også på de obligatoriske kursene for leger og teknisk personale som ville spesialisere seg i nukleærmedisin samt på grunnutdanningen for radiografer. Farmasøytene får også en innføring i radiofarmasi både ved farmasistudiene i Oslo og Tromsø og ved Reseptar høyskolen. Undervisningen på farmasistudiene førte til at en rekke studenter utførte sine hovedoppgaver på Kjeller. Den første doktorgraden i radiofarmasi kom i 1999 og flere har kommet til senere (17). Gjennom farmasøytisk etterutdannelse ble det tidligere holdt felles nordiske kurs i radiofarmasi i Norge. Med disse kursene håpet man spesielt å gi et tilbud til de sykehusfarmasøyter som ville lære noe om dette fagområdet.
Gjennom de siste 30 år er det mange farmasøyter i Norge som har fått anledning til å stifte nærmere bekjentskap med radiofarmasi området og som fant at det sammensveisete arbeidsmiljøet, arbeidet i team mot et felles mål og ikke minst den nære kontakten mot sykehusavdelingene var så interessant at det ble hovedkjernen i yrkeskarrieren. Det kan i dag fastslås at farmasøytene som har arbeidet på Kjeller har satt viktige spor etter seg. Ved Institutt for Energiteknikk, som er Norges nest største teknologiske institutt, er i dag to av de viktigste stillingene besatt av farmasøyter. Både direktøren ved instituttet, Eva Sandanger Dugstad, og forskningssjefen for nukleær virksomhet på Kjeller, Brit Solveig Farstad, er farmasøyter med bakgrunn fra Isotoplaboratoriene. Også innen GE Healthcare med sin meget omfattende globale virksomhet har farmasøyter fra Kjeller innehatt meget høye stillinger, blant annet, Ole Kristian Hjelstuen, som konsernets øverste leder for forskning og utvikling av kontrastmidler og radiofarmaka.
Etter mer enn 40 år med kontinuerlig produksjon av radiofarmaka ved IFE, skjedde det i 1996 store endringer. Dette var på et tidspunkt hvor nukleærmedisinen endelig var blitt godkjent som egen medisinsk spesialitet i Norge. Som følge av dette forventet man stor ekspansjon innen dette fagfeltet. Det var i hovedsak ytre forhold som fremtvang forandringene på Kjeller. EØS-avtalen førte til en omfattende omlegging av systemene for legemiddelomsetning i Norge, blant annet ved at statlig monopol på engros salg av legemidler gjennom Norsk Medisinal Depot ble opphevet (18). På samme måte ble det nå nødvendig å skille produksjon av radiofarmaka fra kontroll og distribusjonsvirksomhet. Enkelte av de større utenlandske produsentene av radiofarmaka hadde stilt spørsmål om IFE ved siden av å ha et monopol for import og distribusjon også kunne være en stor produsent av radiofarmaka. Sosial- og Helsedepartementet startet utredning om fremtidig opplegg for distribusjon og kontroll i 1994 (19), og det kom samtidig signaler om mulige endringer i myndighetenes politikk med hensyn til økonomisk støtte til den nukleære virksomheten på Kjeller.
IFE begynte derfor å se seg om etter mulige samarbeidspartnere, slik at videre drift av produksjonsvirksomheten kunne sikres. To av de største produsentene i Europa meldte sin interesse, men forhandlinger ble ikke innledet med disse firmaene da det ble klart våren 1995 at også norske Nycomed Imaging var interessert i å satse på radiofarmasiområdet.
IFE – Isopharma – Nycomed Amersham – GE Healthcare
Nycomed Imaging var blant verdens ledende produsenter av kontrastmidler for røntgen, ultralyd, computertomografi (CT) og magnetisk resonans (MR), men manglet legemidler innenfor den siste av de store billeddannende teknikkene: nukleærmedisinen. Isotoplaboratoriene på IFE hadde gjennom årene hatt flere spennende og vellykkete forskningsoppdrag for Nycomed, og det var derfor naturlig for IFE å starte forhandlinger med det norske selskapet. Våren 1996 ble det enighet om å starte et firma hvor hver av partene eide 50 prosent av aksjene. Det nye firmaet fikk navnet Isopharma AS og var i drift allerede fra 1. september 1996. Et knapt år senere fusjonerte Nycomed Imaging med Amersham International, som var verdens ledende produsent av radiofarmaka og radioaktive kjemikalier. Etter tre års virksomhet kjøpte Nycomed-Amersham IFE’s del av aksjene i Isopharma, slik at firmaet ble et heleid datterselskap innen konsernet. Nycomed-Amersham tok senere navnet Amersham Health, og fusjonerte så med General Electric Healthcare (GE Healthcare) i 2004.
Etter etableringen av Isopharma i 1996 kunne Isotoplaboratoriene ved IFE rendyrke kontroll- og distribusjonsvirksomheten. IFEs viktigste oppgave ble å forsyne de norske sykehusene med radiofarmaka, og målet var å opprette et isotopapotek, som skulle ivareta kontroll og distribusjon av alle radiofarmaka for det norske markedet. Dette mente man var viktig for å ivareta sikkerheten til den enkelte pasient, samt til en trygg distribusjon av de radioaktive produktene.
Et isotopapotek ble aldri formelt opprettet, men Isotoplaboratoriene ved IFE har hele tiden fungert som et nasjonalt isotopapotek, der hvert enkelt radioaktivt legemiddel blir bestilt av avdelingen hos de ulike produsentene, og gjennomgår både en farmasøytisk og strålevernsrelatert kontroll på Kjeller før det pakkes og sendes videre til det enkelte sykehus. I 2006 fikk IFE formalisert sin detaljistvirksomhet gjennom en utvidet grossisttillatelse som omfatter detaljhandel med radiofarmaka (20).
Isotoplaboratoriene ved IFE har etablert seg som et nasjonalt kompetansesenter for håndtering av radioaktive legemidler, og det har vært viktig å videreføre den gode kontakten med brukerne av radiofarmaka ved sykehusene. IFE skal være nøytralt informative overfor de nukleærmedisinske avdelingene og leverandørene, samtidig som de står til disposisjon for norske legemiddelmyndigheter i spørsmål som angår omsetning og bruk av radiofarmaka i Norge.Videre representerer IFE Norge som en uavhengig instans i flere fora innen europeisk radiofarmasi. For tiden har IFE to representanter i «Radiopharmacy committee» i den europeiske nukleærmedisinske foreningen (EANM), som arbeider med utarbeidelse av felles europeiske retningslinjer for håndtering og tilberedning av radiofarmaka på sykehus, samt med videreutdanning og sertifisering innen radiofarmasi. I tillegg representeres Norge i gruppe 14 i Den europeiske farmakopé (EDQM) av en farmasøyt fra IFE.
Transportkostnader utgjør en stor del av produktprisen for radiofarmaka, og IFE samsender produkter fra ulike leverandører til de enkelte sykehusene der dette er praktisk mulig, for å redusere de totale kostnadene. Årlig kontrolleres og distribueres det i overkant av 6000 bestillinger av radiofarmaka fra IFE’s laboratorier på Kjeller, fordelt på ca. 2500 transporter. Dette tilsvarer radioaktive legemidler anvendt til omkring 70 000 undersøkelser hvert år.
IFE har rutiner for priskontroll for varer med godkjent markedsføringstillatelse og pris for det norske markedet, basert på de oversikter som myndighetene utarbeider over godkjente priser.
Spesialproduksjon av radiofarmaka
Som et ledd i å forsyne det norske markedet med radiofarmaka har Isotoplaboratoriene tillatelse til å spesialprodusere legemidler som ikke er kommersielt tilgjengelige. Det kan skyldes at de har for kort levetid til å kunne importeres fra andre land, eller fordi de ikke lages andre steder. Radiofarmaka til kliniske utprøvinger er også et typisk eksempel på produkter som Isotoplaboratoriene kan fremstille, som et ledd i å tilrettelegge for tilgang til nye produkter for norske sykehus. Det første av disse spesialproduksjonene var [18F] fluor-deoxyglucose (FDG), et PET (Positron Emisjon Tomografi) preparat. (PET radiofarmaka beskrives nærmere i avsnittet «Ny teknologi – nye radiofarmaka»)
Da GE Healthcare valgte å legge ned sin produksjonsvirksomhet på Kjeller, ble IFE alene om å drifte GMP-fasilitetene på Kjeller. Dette er kostbar infrastruktur, og IFE vurderte en periode om de skulle opprettholdes som lokaler for legemiddelproduksjon, eller overføres til annen bruk i instituttets forskning. Det var slik sett strategisk viktig nettopp for denne delen av virksomheten da IFE inngikk avtale med legemiddelfirmaet Algeta i juli 2010 om å bygge opp produksjonsfasiliteter for Algetas alfa-legemiddel til kreftterapi. IFE har helt siden 2001 stått for farmasøytisk tilberedning av dette produktet til klinisk utprøving, og har produsert og distribuert alle doser fra Fase I til Fase IIIstudiene.
Arbeid med radionuklider som sender ut alfastråling var nytt også for Isotoplaboratoriene ved IFE, og det er bygd opp en betydelig kompetanse på håndtering av spesielt [223Ra] radium i løpet av disse 10 årene. En oppskalering av produksjonen for et kommersielt marked betyr en omfattende ombygging og modernisering av store deler av produksjonsfasilitetene, dedikert til denne produksjonen.

Denne oppskaleringen betyr også en stor vekst i avdelingens ressurser og personell.
Mens Isotoplaboratoriene etter at Isopharma ble etablert i 1996 talte 14 personer, utgjør nå denne virksomheten en gruppe på 28 personer, og det forventes en ytterligere tilvekst på 10–15 nye personer innen utgangen av 2011. Denne styrkingen av gruppen, samtidig med at deler av laboratoriene fremdeles skal være tilgjengelig for spesialproduksjon av eventuelle nye radiofarmaka, bidrar til positive framtidsutsikter for radiofarmasimiljøet i Norge.
Utvikling av nye radiofarmaka har hele tiden vært nært knyttet til de muligheter utviklingen av ny teknologi og forbedret deteksjonsutstyr har gitt nukleærmedisinen. I begynnelsen kunne man bare studere opptak av det radioaktive legemiddelet i enkeltorganer, og bildedokumentasjonen var ikke særlig imponerende sammenlignet med røntgenundersøkelser. Men med de teknologiske fremskritt og ikke minst revolusjonen innen databehandling av måleresultatene kunne avbildingene forbedres vesentlig. Det ble også mulig å måle funksjonen i ulike organer, ikke bare foreta en avbilding.
Ny teknologi innen radiologien, som CT (Computer Tomografi) og MR (Magnetisk Resonans) førte til at nukleærmedisinen i en periode kom litt i bakleksa i forhold til andre undersøkelsesmetoder. Dette endret seg på slutten av 1990-tallet med en eksplosiv økning av undersøkelser med radiofarmaka på grunn av store fremskritt med PET (Positron Emisjon Tomografi) diagnostikk. Selve teknologien var ikke ny, allerede i begynnelsen av 1980-årene var PET-kameraer i drift i Stockholm og Uppsala, men de ble mest brukt i forskningsøyemed.
PET kommer på banen for alvor
Teknikken ble brukt i neurologi og hjerteforskning, men etter hvert kom også anvendelsen innen kreftdiagnostikk. Da injiseres en liten mengde med druesukker (glukose) merket med den radioaktive isotopen Fluor [18F] fluor (21). Legemiddelet tas opp i de områder i kroppen hvor det er størst behov for energi. Kreftceller i delingsfasen krever mer energi enn omliggende normale celler, og derfor vil det radioaktive druesukkeret tas opp i kreftcellene i større grad enn i de friske cellene. På denne måten kan et aktivt kreftområde påvises på et meget tidlig tidspunkt i sykdomsutviklingen.
På 1990-tallet ble det registrert en betydelig økning av slike undersøkelser både i USA og Europa, idet teknologiske fremskritt gjorde det mulig å detektere mindre og mindre svulster. Enda viktigere ble denne teknikken da nytt teknisk utstyr ved sykehusene gjorde det mulig å kombinere PET undersøkelser med CTeller MR-undersøkelser. I 2001 fantes det over 100 PET-miljøer i Europa. I Vest-Europa var det nå bare Island, Portugal og Norge som ikke hadde tilgang til bruk av denne teknologien. I Norge måtte man ty til en billigere og ikke på langt nær så eksakt teknologi, ved at det ble benyttet konvensjonelle gammakameraer med roterende detektorer. Løsningen ble ofte kalt «Fattigmanns PET».
For å kunne bruke denne teknologien er det viktig å ha tilgang på [18F] fluordeoxyglucose (FDG) merket med [18F] fluor. I 1997 ønsket to Oslo-sykehus å kjøpe [18F] fluor-deoxyglucose. IFE var behjelpelig med å importere dette fra Rigshospitalet i København, som den gang var den nærmeste produsenten. Dette viste seg som en mindre vellykket løsning idet halveringstiden for isotopen [18F] fluor er bare snaut to timer. Ved isotoplaboratoriene på IFE tok man utfordringen og startet produksjon av dette legemiddelet, selv om det på dette tidspunktet ikke fantes noe marked for det i Norge. Utfordringen her er ikke bare rent farmasøytisk, men også nukleær, idet isotopen Fluor-18 ikke kan fremstilles ved en enkel reaktorbestråling. Fremstilling av isotopen foregår derfor i en partikkelakselerator: en syklotron. På grunn av den korte halveringstiden må fremstillingen skje så nær brukerstedet som mulig. IFE startet derfor en spesialproduksjon av [18F] fluor-deoxyglucose i egne lokaler, i samarbeid med de to sykehusene og Fysisk Institutt ved Universitetet i Oslo. Sykehusene kjøpte selv inn produksjonsutstyr og plasserte dette på Kjeller, der IFE bygde dette inn i en GMP-produksjon. Fysisk Institutt i etablerte en produksjonslinje for [18F] fluor ved det eksisterende syklotronlaboratoriet på Blindern, også dette i tett samarbeid med Radiumhospitalet.
Dette utmerkede trekantsamarbeidet medførte at sykehusene fikk levert 6–8 pasientdoser Fluor-18 FDG ukentlig fra 1999 og helt til GE Healthcares kommersielle produksjon var etablert i oktober 2006. Denne spesialproduksjonen av Fluor-18 FDG i disse årene ble en viktig forutsetning for etableringen av FDG-PET i Norge. I dag er denne produksjonen vel etablert hos GE Healthcare i Oslo, og man er i ferd med å starte rutinemessig produksjon ved PET senteret i Bergen.
Høsten 2009 startet forberedelsene til produksjon av et nytt PET-radiofarmaka, Gallium-68 DOTATOC ved Isotoplaboratoriene. Dette produktet er for tiden ikke kommersielt tilgjengelig i Norge, men det etterspørres av flere norske sykehus. DOTATOC er en somatostatin-analog som bindes spesifikt til kreftceller med reseptorer for somatostatin, og vil være et verdifullt produkt for nukleærmedisinsk kreftdiagnostikk. Et samarbeid mellom IFE, Norsk medisinsk syklotronsenter i Oslo og PET-senteret i Bergen er etablert for oppbygging av Gallium-68 DOTATOC-produksjon for Oslo-regionen og Bergens-regionen. Produksjonen for Oslo-regionen vil i første omgang foregå på Isotoplaboratoriene ved IFE.
Økonomiske problemer forsinket bruken av PET diagnostikk i Norge
Veien frem til et fullverdig PET-tilbud for norske pasienter var lang og tornefull. Den første offentlige utredning kom allerede i 1986 (22). Det ble da konkludert med at det var et meget godt forskningsverktøy, men at det var usikkerhet om teknologien ville få anvendelse klinisk i fremtiden. Nye utredninger fulgte utover i 90-årene, og det var forventet at et PET-senter ville bli etablert ved ferdigstillelsen av det nye Rikshospitalet på Gaustad. Endelig i 2001 ble det besluttet å etablere et nasjonalt PET-nettverk med en syklotron for produksjon av radionuklider lokalisert til Rikshospitalet (23), og med PET-skanner både på Rikshospitalet og på Radiumhospitalet. En av grunnene til at det tok så lang tid var selvsagt kostnadsspørsmålet. Det tekniske utstyret og innredning av lokaler utgjorde ca. 100 millioner kroner, og i tillegg kom store driftskostnader.
Engangsinvesteringen ble betydelig lettere da GE Healthcare ga 25 millioner kroner i bidrag til innkjøp av syklotron og to skannere. Norsk medisinsk syklotronsenter AS (NMS AS) ble etablert i 2003. Selskapets formål er forskning og produksjon knyttet til radiofarmaka for medisinsk diagnostikk, og det kom i operativ drift fra høsten 2006. Senteret eies av Oslo Universitetssykehus og Universitetet i Oslo og har fått økonomisk tilskudd fra Forskningsrådet. GE Healthcare AS leier laboratorier og utstyr for å produsere [18F] fluor-deoxyglucose, mens isotopen [18F] fluor produseres av NMS AS.
Det andre PET-senteret i Norge, som også ble etablert med store private gaver, ligger i Bergen. Våren 2011 fikk også Oslo Universitetssykehus, avdeling Ullevål, en PET skanner som var finansiert ved en gave fra en kreftforening.
Utover dette finnes det i dag i Norge ytterligere to muligheter for PET-undersøkelse: I Oslo har den første private aktøren kommet på banen etter at firmaet Aleris tok i bruk sin første skanner høsten 2010. Universitetssykehuset i Tromsø får rutinemessig besøk av en trailer med en mobil PET-skanner og en liten «hot-lab». Fluor-18 FDG til disse undersøkelsene leveres av en finsk radiofarmakaprodusent, som flyr dette direkte inn til Tromsø fra Helsinki. IFE er ansvarlig grossist og detaljist også for dette produktet, og foretar de samme kontrollene, om enn organisert noe annerledes enn når produktene sendes via Kjeller. Den første FDG-PET undersøkelsen i Tromsø, som også ble betegnet som verdens nordligste undersøkelse med dette produktet, ble foretatt i september 2008 (24).
Syklotroner og legemiddelfremstilling ved sykehusene
Produksjonen av PET-radiofarmaka var i de første årene ganske forskjellig fra annen produksjon av radiofarmaka. I Europa var syklotronene som produserte de radioaktive nuklidene som regel knyttet til universiteter og tekniske høyskoler. Produksjonen og kontrollen av legemiddelet ble derfor utført ved disse institusjonene, ofte i lokaler som ikke var egnet til slike oppgaver, og legemidlene ble deretter distribuert til nærliggende sykehus. Men etter hvert som den kliniske bruken økte ble det mer og mer vanlig at selve syklotronen ble bygget på sykehusområdet og at også legemiddelet ble fremstilt der.
Det ble en stor utfordring å gjøre det mulig med så omfattende lokal produksjon og samtidig ta vare på kvalitetsaspektet. Bare det å sikre seg tilgang til råvarer av tilfredsstillende farmasøytisk kvalitet til bruk i syntesen av legemiddelet var problematisk nok. Flere produsenter startet nå med å bygge små, automatiske syntesemaskiner for produksjon av fluor-18 FDG, men ikke alle la spesiell vekt på de farmasøytiske kravene ved design av utstyret.

«FASTlab»
Den av produsentene som virkelig la farmasøytiske prinsipper til grunn var imidlertid GE Healthcare. Forskning og utvikling av både radiofarmaka og synteseapparatur var i Norge lokalisert både på Kjeller og på Storo i Oslo, og her fikk miljøene virkelig en stor sjanse til å være med på spennende prosjekter. De norske farmasøytene og ingeniørene fikk for eksempel være med på utvikling av de kjemiske prosessene, utarbeidelse av software for å styre prosessene, design av produksjonsenheten og valg av råvarer. Det endelige produktet, «FASTlab», leveres som en helautomatisk syntesemaskin, som kan produsere en rekke ulike radiofarmaka merket med [18F] fluor. For fremstilling av de ulike legemidlene leveres det kassetter med alle de substanser og væsker som er nødvendige for syntesen, og i tillegg et spesifikt dataprogram for styring av produksjonen av det aktuelle legemiddelet.Alle råvarene leveres sterile og syntesen foregår i et lukket system. Dette vil gjøre det mulig for sykehusene lokalt å produsere flere ulike radiofarmaka av fullverdig farmasøytisk kvalitet på samme dag, med lave stråledoser til operatørene og sikker håndtering av det radioaktive avfallet.
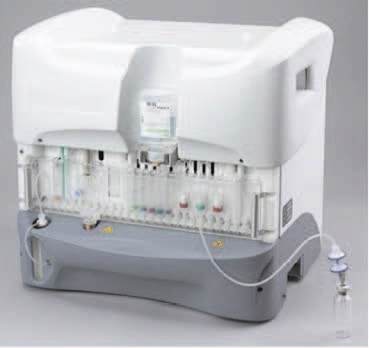
Legemiddelproduksjon om natten
På grunn av isotopens korte halveringstid har fluor-18 FDG usedvanlig kort brukstid. Produksjon, kontroll, distribusjon og bruk må derfor være meget godt koordinert. Derfor starter produksjonen av det radioaktive legemiddelet på nattetid. Produsenten av legemiddel og syklotronoperatøren starter på arbeid ved tretiden om natten for å forberede produksjonen. Legemiddelprodusenten har klargjort syntese og dispenseringsutstyret til kl 6:00, samtidig med at syklotronen har bestrålt materialet som omdannes til [18F] fluorid tilstrekkelig lenge til at aktiviteten kan overføres til synteseenheten, som er montert inne i hot-cellen i produksjonsrommet. Selve syntesen tar 30–40 minutter. Parallelt med dette har ansvarshavende for kvalitetskontrollen gjort sine forberedelser slik at når analyseprøven av dagens produkt foreligger ca. kl 7:00, er alle anlyseinstrumenter startet opp og standardkurver klare. En rekke forskjellige analyser utføres med ulike teknologier. Kjemisk renhet blir testet med både gass-kromatograf og HPLC. Radiokjemisk renhet blir også testet med HPLC og tynnsjiktskromatografi.
Produktets mikrobiologiske status blir sjekket med raske tester, mens selve steriltesten blir utført i ettertid. Går alt etter programmet er produktet godkjent for bruk kl 8:30, det vil si to og en halv time etter at selve syntesen av legemiddelet ble startet.
For ytterligere å spare tid er det lagt opp til at forsendelse til sykehus kan starte før analysene er klare.Telefonisk og skriftlig kontakt er nødvendig før preparatet anvendes. På denne måten sikres en rask og effektiv produksjons og distribusjonslinje for at mest mulig av aktiviteten blir gjort tilgjengelig for pasientundersøkelser.
Da GE Healthcare ved årsskiftet 2008/09 besluttet å legge ned produksjonen av de konvensjonelle radioaktive legemidlene på Kjeller, kunne det se mørkt ut for radiofarmasien i Norge, etter nesten 60 års kontinuerlig produksjon og utvikling av radiofarmaka. Heldigvis ser fremtidsperspektivet i dag alt annet en mørkt ut.
Isotoplaboratoriene ved IFE
Her ligger fremdeles det nasjonale ansvaret for kontroll og distribusjon av radiofarmaka til norske sykehus, samt produksjon av radioaktive legemidler til kliniske studier. IFE er også involvert i forskning og utvikling av nye produkter i samarbeid med norske sykehus
GE Healthcare
GE Healthcare har fremdeles en aktiv gruppe i Norge som driver forskning og utvikling av nye PETradiofarmaka.
GE Healthcares produksjon av [18F] fluordeoxyglucose i PET-senteret ved Rikshospitalet blir betegnet som firmaets mest vellykkede satsing på dette området i Europa. Det er mange ting som kan gå galt når et komplisert produkt med ekstremt kort holdbarhetstid skal produseres, kontrolleres, distribueres og brukes i løpet av noen få timer. Senteret i Oslo har vist seg å være usedvanlig dyktig til å levere i tide, slik at man unngår at pasientene må sendes hjem igjen. I dag leverer senteret til tre PET-skannere ved Oslo Universitetssykehus (Radiumhospitalet, Rikshospitalet og Ullevål Sykehus) og til den private klinikken Aleris.
Radiofarmasøytisk produksjon ved PET sentrene i Oslo og Bergen
Fra Oslo har det også vært regelmessige leveranser til Haukeland sykehus i Bergen siden 2009. Leveransene til Haukeland sykehus har foregått med chartrete fly for å gjøre transporten så effektiv som mulig. Nå står senteret i Bergen foran nye utfordringer. Etter flere års innsats fikk de våren 2011 endelig tilvirkertillatelse fra Statens Legemiddelverk og kan nå starte sin egen produksjon av PET-radiofarmaka.
I Oslo er det også en videreutvikling av PET- radiofarmaka virksomheten. Det overordnede mål for Norsk medisinsk syklotronsenter er å levere både etablerte og nye radiofarmaka og kjemiske forbindelser for bruk i rutinemessige og forskningsbaserte PET- undersøkelser i Norge. Forskningen har vært ivaretatt i samarbeid med Universitetet i Oslo og universitetssykehusene i Oslo området. NMS har også hatt som målsetning å oppnå tilvirkertillatelse fra Statens Legemiddelverk slik at senteret selv kan produsere nye PET- radiofarmaka. Målbevisst innsats førte til at senteret fikk tillatelsen våren 2011. Det første nye produktet det vil bli aktuelt å produsere der er [18F] natriumfluorid.
Det vil bety mye for utviklingen av PET-miljøer i Norge at både Haukeland sykehus i Bergen og NMS innehar tilvirkertillatelse for radiofarmaka. Ikke minst vil det ha stor betydning for muligheten til å bruke disse nye PET-relaterte hjelpemidlene i avansert forskning ved universitetene og sykehusene. I dag finnes det i Norden meget anerkjente PET-sentre i København, Stockholm og Turku, som ligger på øverste nivå i Europa når det gjelder slik forskning. Målsetningen er at vi i løpet av noen år har etablert et senter på tilsvarende høyt nivå i Oslo.
Terapi-produkter fra laboratoriene på Kjeller
Den aller største gledelige nyhet innen norsk radiofarmasi finner vi i det som foregår på Kjeller i disse dager. Det er den store satsningen som det norske firmaet Algeta og Institutt for Energiteknikk samarbeider om. Algeta har sitt hovedkvarter i Oslo og er i dag verdensledende på medisinsk bruk av isotoper som sender ut alfastråling og i utvikling av alfapartikkelbaserte radiofarmaka. Dette er en ny type legemidler til kreftterapi hvor alfastrålingen brukes til å drepe kreftcellene som ligger i umiddelbar nærhet av det området legemiddelet tas opp. Teknologien som anvendes er basert på forskningsarbeid utført ved Radiumhospitalet og Rikshospitalet. De to mest lovende isotopene det arbeides med nå er [223Ra] radium og [202Th] thorium.
Det første produktet, Alpharadin, er basert på [223Ra] radiumklorid, og dette produktet har nådd frem til fase III i klinisk utprøvning. Isotoplaboratoriene ved IFE har hatt ansvar for den farmasøytiske produksjon og distribusjon av Alpharadin for de kliniske studiene Algeta gjennomfører ved over 100 sentre rundt om i verden. I 2009 inngikk Algeta en avtale verd 800 millioner dollar med Bayer Schering Pharma AG for utvikling og global kommersialisering av Alpharadin til behandling av prostatakreft og andre kreftformer med hyppig spredning til skjelettet, som for eksempel brystkreft.
I juli 2010 ble det inngått en avtale mellom Algeta og IFE om en omfattende utvidelse av samarbeidet mellom de to partene. Algeta fremhever at lokal ekspertise med lang erfaring på fagområdet, tilgjengelige lokaler, infrastruktur og et meget godt samarbeid med IFE i den innledende fasen var grunnen til at de valgte å satse på IFE også i fremtiden. I følge avtalen vil IFE utvide den eksisterende produksjonskapasiteten for Alpharadin. Oppgraderingen skal finansieres av Algeta og den vil gi tilgang på «state-of-the-art» fasiliteter som har kapasitet til både fremtidige kliniske studier og til kommersielle leveranser etter at produktet er lansert.
I dag produseres og distribueres ca. 100 doser per måned til klinisk prøving. Ved en kommersiell produksjon vil behovet for doser mangedobles. Produksjonskapasiteten ved IFE må derfor økes tilsvarende. Det er ventet at denne kapasitetsøkningen vil medføre opprettelse av ca. 40 nye stillinger ved Isotoplaboratoriene for å dekke produksjonsbehovet. Algeta-satsingen i Norge har stor betydning for hele det norske radiofarmasimiljøet og betyr ikke minst svært mye for å videreføre den tradisjonsrike virksomheten ved Institutt for Energiteknikk.
Derfor er det med glede at en ser frem til å følge den videre utviklingen på dette lille, men utrolig spennende fagområdet: Radiofarmasi i Norge!